Introduction
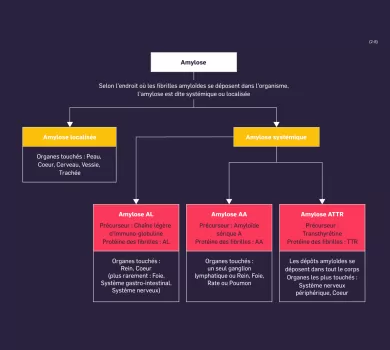
Les amyloses constituent un large groupe hétérogène de maladies liées à l’accumulation extracellulaire de fibrilles amyloïdes, de façon localisée ou systémique(1) . La localisation et le type de dépôts amyloïdes, ainsi que de la toxicité de précurseurs solubles entrainent des manifestations cliniques différentes ainsi que des atteintes d’organes différentes (cœur, rein, système nerveux périphérique, tube digestif…)(2). Sur les 36 précurseurs protéiques responsables d’amyloses, environ 1/3 entrainent des amyloses systémiques. Elles peuvent toucher de nombreux organes, mais c’est l’atteinte cardiaque qui conditionne le pronostic de la maladie.(1) Il est donc primordial d’identifier leurs signes évocateurs.(2)
Il existe différents types d’amyloses systémiques, les 3 principaux responsables d’atteintes cardiaques étant :
- L’amylose AL (amylose à chaînes légères d’immunoglobulines)
- L ’amylose AA (amylose à sérum amyloïde A) également appelée « amylose inflammatoire »
- L’amylose ATTR (amylose à transthyrétine)(3)
1
L’amylose AL
L‘amylose AL se définit par l’accumulation de dépôts insolubles d’immunoglobulines à chaines légères, produites en excès dans le cadre d’une gammapathie monoclonale de signification indéterminée (MGUS), d’un myélome ou plus rarement d’un lymphome.(1) Les organes les plus fréquemment touchés sont les reins, le cœur et le système nerveux périphérique.(5) Actuellement, c’est le type d’amylose le plus fréquemment diagnostiqué, survenant chez 70 % des patients atteints d’amylose.(4)
Le délai moyen entre les premiers symptômes et le diagnostic est estimé à 2 ans et l’âge médian au moment du diagnostic est de 63 ans.(1,8) Les patients doivent être rapidement pris en charge afin de limiter la prolifération plasmocytaire. On estime que la survie médiane après le diagnostic en présence d'atteinte cardiaque est d'environ 6 mois en l'absence de traitement.(5)
2
L’amylose AA
L’amylose AA se définit par l’accumulation de dépôts insolubles du précurseur sérique de la protéine amyloïde A dans les organes. La sérum amyloïde A (SAA) est une protéine de la phase aiguë de l’inflammation, majoritairement produite par le foie sous l’action de cytokines pro-inflammatoires.
Dans certains cas, impliquant d’intenses processus inflammatoires, cette protéine voit sa conformation modifiée afin de former la protéine amyloïde A, polypeptide d’environ 8 kDa et composée de 75 acides aminés. Cette structure riche en feuillet bêta va former du fait de son accumulation des fibrilles insolubles résistantes aux protéases.(6)
3
L’amylose à transthyrétine
L’amylose à transthyrétine (ATTR) se définit par l’accumulation de dépôts insolubles de transthyrétine (protéine de transport) sous forme de fibrilles amyloïdes dans le système nerveux périphérique et des organes tels que le cœur, les reins, le tractus gastro-intestinal et les yeux.(9)
Dans le cas de l’amylose ATTR, il est communément admis que les fibrilles amyloïdes elles-mêmes peuvent causer des dommages tissulaires directs par compression/obstruction ou en altérant la circulation sanguine locale.(7) Le syndrome du canal carpien est représentatif de ces troubles induits par le dépôt massif de fibrilles amyloïdes et requiert ainsi une chirurgie.(7) Des dépôts oculaires peuvent entrainer une opacité du vitrée ou un glaucome, nécessitant également une chirurgie.(8) L’état fonctionnel et la qualité de vie du patient continuent de se détériorer au fur et à mesure de l’accumulation des dépôts amyloïdes. On assiste donc à une progression inexorable et irréversible de la maladie.(7)
Ce qu’il faut retenir
Bien que diverses, les amyloses systémiques responsables d’une atteinte cardiaque ont pour point communs d’être des maladies mortelles, évolutives et irréversibles dont la découverte chez le patient est souvent retardée. Savoir identifier les signaux évocateurs d’amylose est primordial pour enclencher un diagnostic et une prise en charge du patient le plus tôt possible, car des solutions existent.
- S. Oghina, M.A Delbarre, E. Poullot, K. Belhadj, P. Fanen, T. Damy, Les Amyloses cardiaques : état des lieux en 2022, SNFMI 2022, DOI : 10.1016/j.revmed.2022.04.036
- T. DAMY, O. LAIREZ, V. ALGALARRONDO, P. CHARRON, Protocole National de Diagnostic et de Soins (PNDS) AMYLOSES CARDIAQUES 2020-2021, HAS
- Elliott Pr G. Gratteau, Orphanet, Février 2005, consulté en aout 2022
- Milani P, Merlini G, Palladini G. Light chain amyloidosis. Mediterr J Hematol Infect Dis. 2018;10(1):e2018022. DOI: 10.4084/MJHID.2018.022. eCollection 2018
- Donnelly JP, Hanna M. Cardiac amyloidosis: an update on diagnosis and treatment. Cleve Clin J Med. 2017;84(12 suppl 3):12-26. DOI: 10.3949/ccjm.84.s3.02
- C. Poitou , A. Divoux , K. Clément, La sérum amyloïde A : une apolipoprotéine majeure de l’inflammation STV 2008 ; 20, n° 7 : 362-8 DOI: 10.1684/stv.2008.0318
- Y. Ando et al. , Guidelines and new directions in the therapy and monitoring of ATTRv amyloidosis, Amyloid, 2022, DOI:10.1080/13506129.2022.2052838
- Maurer MS, Elliott P, Comenzo R, Semigran M, Rapezzi C. Addressing common questions encountered in the diagnosis and management of cardiac amyloidosis. Circulation. 2017 Apr 4; 135(14): 1357–1377. DOI:10.1161/CIRCULATIONAHA.116.024438
- National Institute of Health, Transthyretin amyloidosis, 18/08/2020
