Votre confrère cardiologue a reçu M. X, diagnostiqué récemment d’une amylose cardiaque*
*Les images anonymisées de ce cas clinique ont été fournies, analysées et commentées par un cardiologue expert en échocardiographie.

Découvrez les images prises par votre confrère et cherchez les indices évocateurs d’une amylose !
ÉTAPE 1. CHERCHER LES INDICES GRÂCE À L’ANALYSE STRUCTURELLE
Réponse
16% des patients bénéficiant d’une implantation de valve aortique (TAVI) pour sténose aortique ont une ATTR-CM de type sauvage. 1


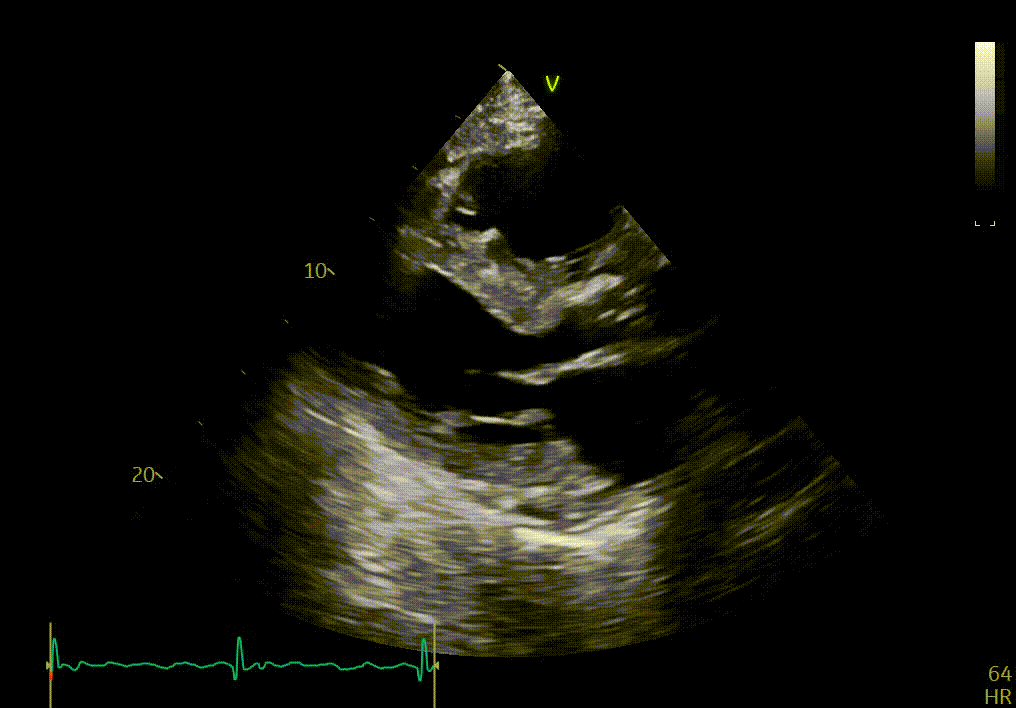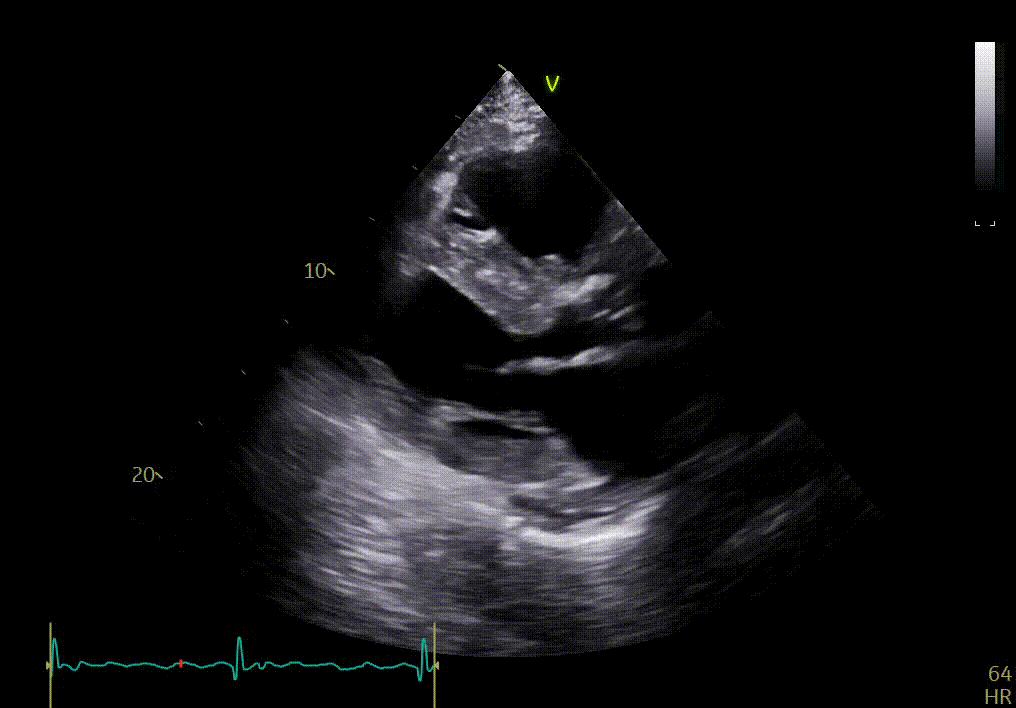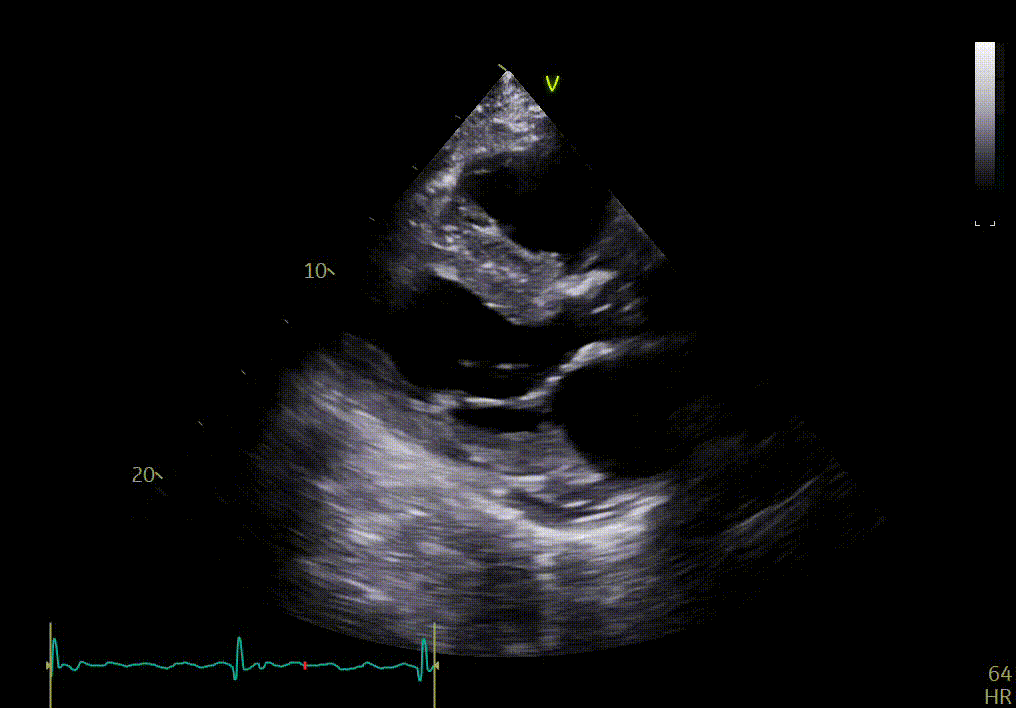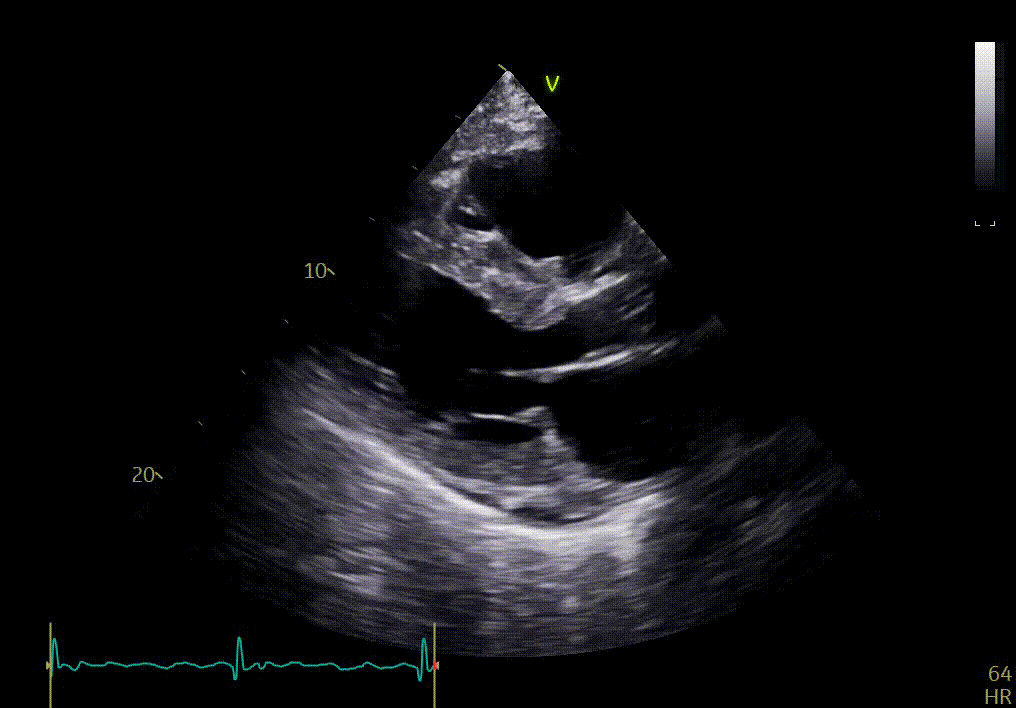
Réponse
Votre confrère a détecté sur cette échocardiographie plusieurs signes :
- Hypertrophie concentrique sévère du VG
- Hyperéchogénicité du septum
- Épaississement des feuillets de la valve mitrale
- Dilatation de l’oreillette gauche
- Raccourcissement longitudinal altéré
- Maladie aortique


{{question3_slider}}/2 {{question3_slider === 1 ? 'Base (valve mitrale)' : 'Segment intermédiaire' }}
Réponse
En plus de confirmer l’hypertrophie concentrique sévère du VG, l’hyperéchogénicité du septum et l’épaississement des feuillets de la valve mitrale, cette vue permet aussi de détecter une hypertrophie du VD (à noter que l'hypertrophie du VD s’observe mieux sur d’autres types de vues).


Apex
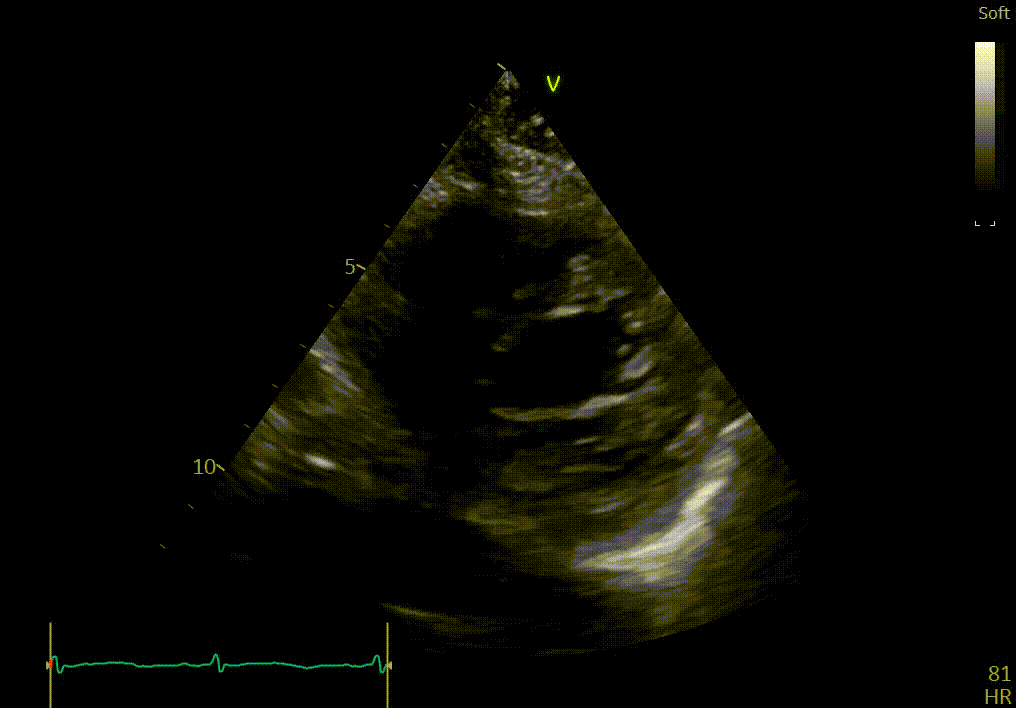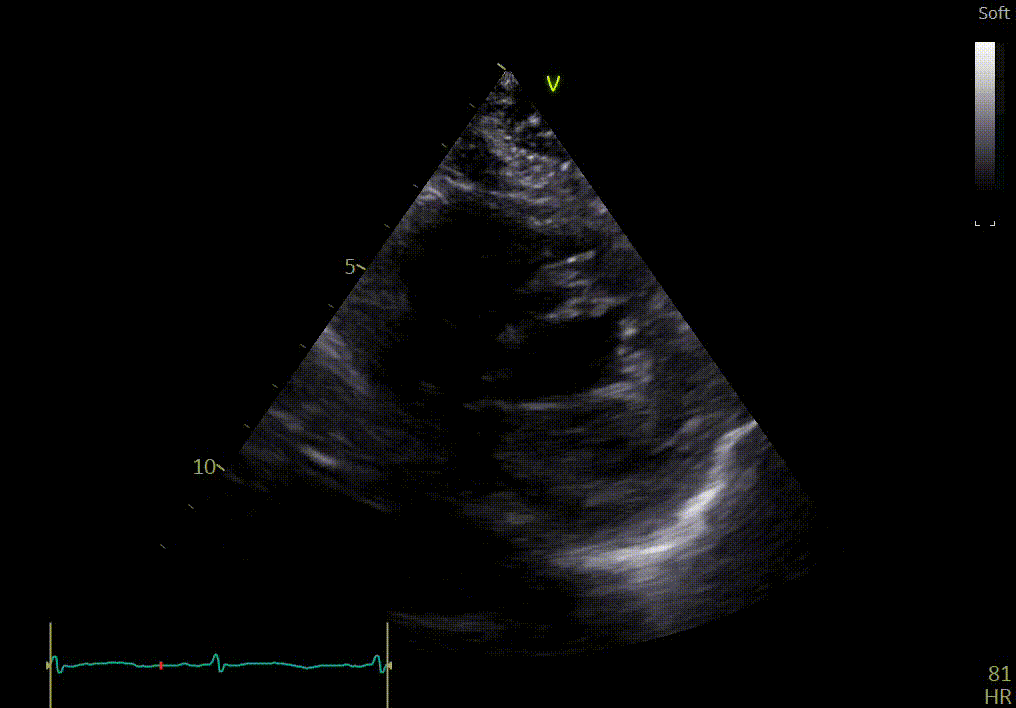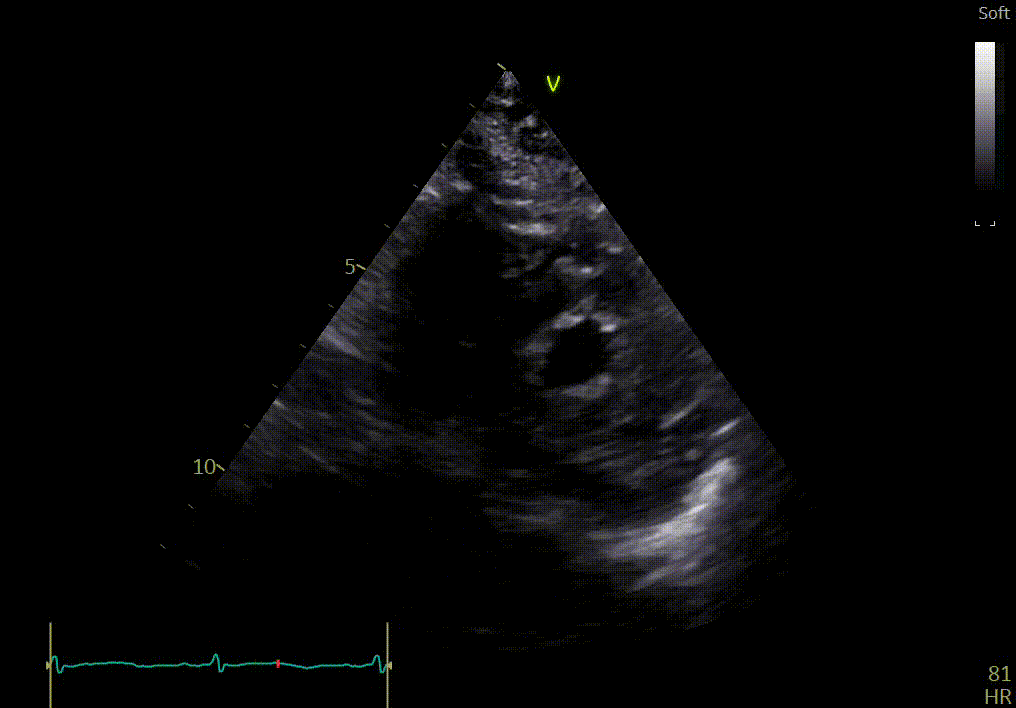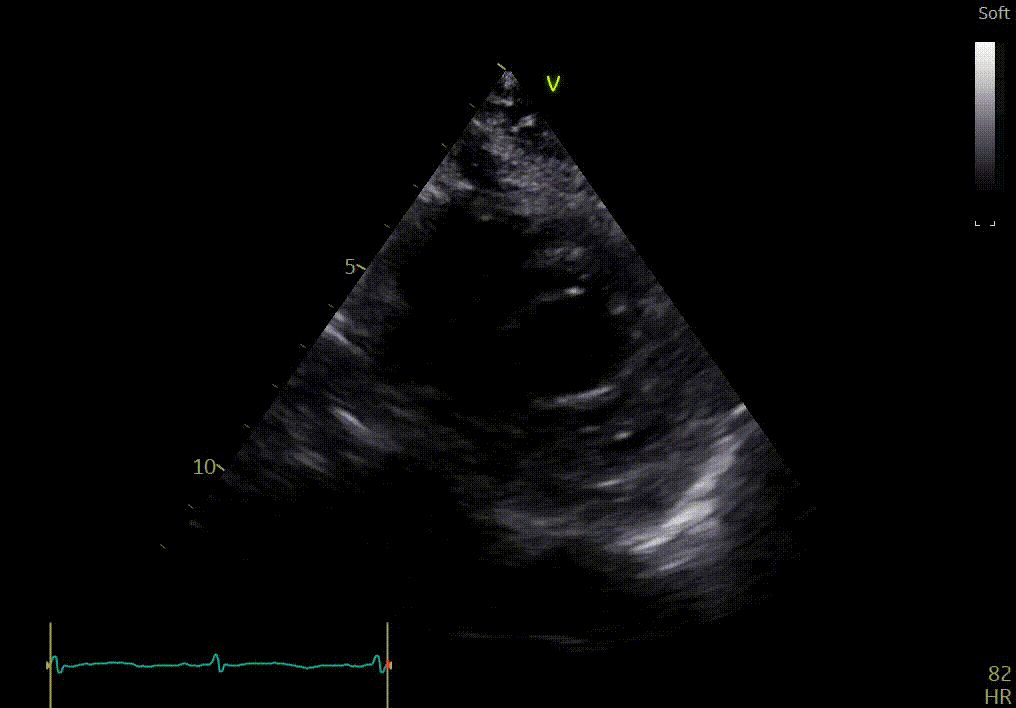
Réponse
L’apex semble bouger relativement normalement, comparé aux autres segments.
Votre confrère précise que la comparaison des différentes vues du petit axe (apex, segment moyen et base) peut montrer une différence dans la fonction longitudinale avec épargne de l’apex, si le strain n’est pas disponible


{{question5_slider}}/2 {{question5_slider === 1 ? 'Vue apicale 4 cavités' : 'Zoom sur l’oreillette gauche' }}
Réponse
Votre confrère a aussi détecté d’autres anomalies sur cette vue apicale :
- Hypertrophie sévère du VG
- Dilatation biauriculaire
- Épaississement de la valve mitrale et tricuspide
- Hyperéchogénicité
- Mouvement angulaire (longitudinal) anormal : l’anneau mitral au niveau de la paroi latérale ne se déplace pas vers l’apex
- Trace d'un épanchement péricardique
L’épanchement du péricarde est confirmé par votre confrère sur les vues sous-costales ci-dessous.
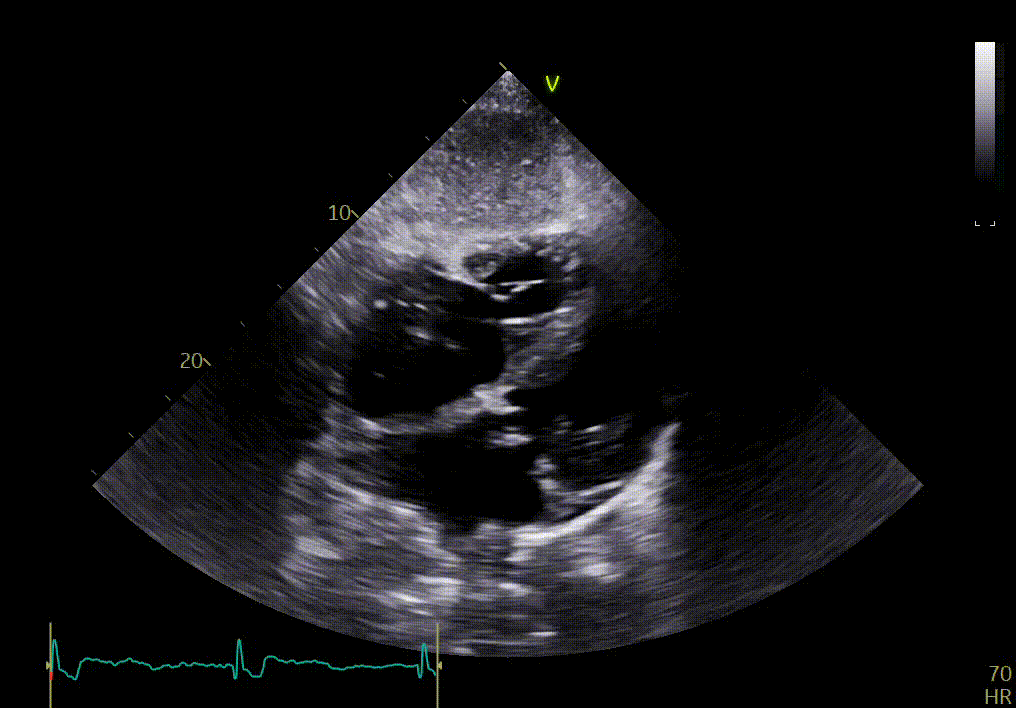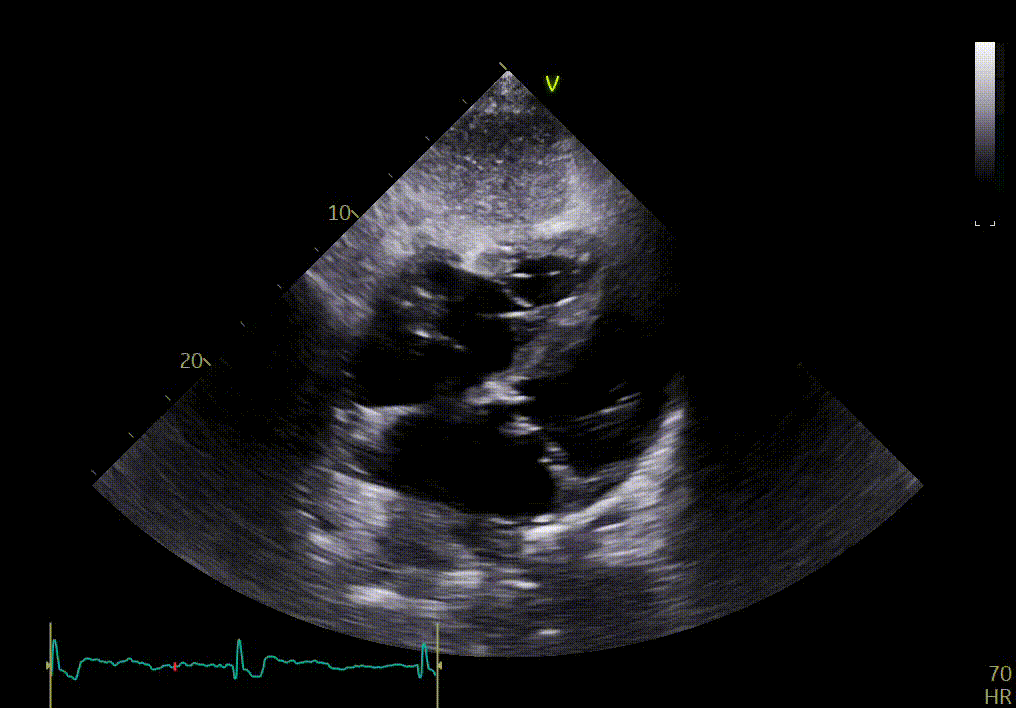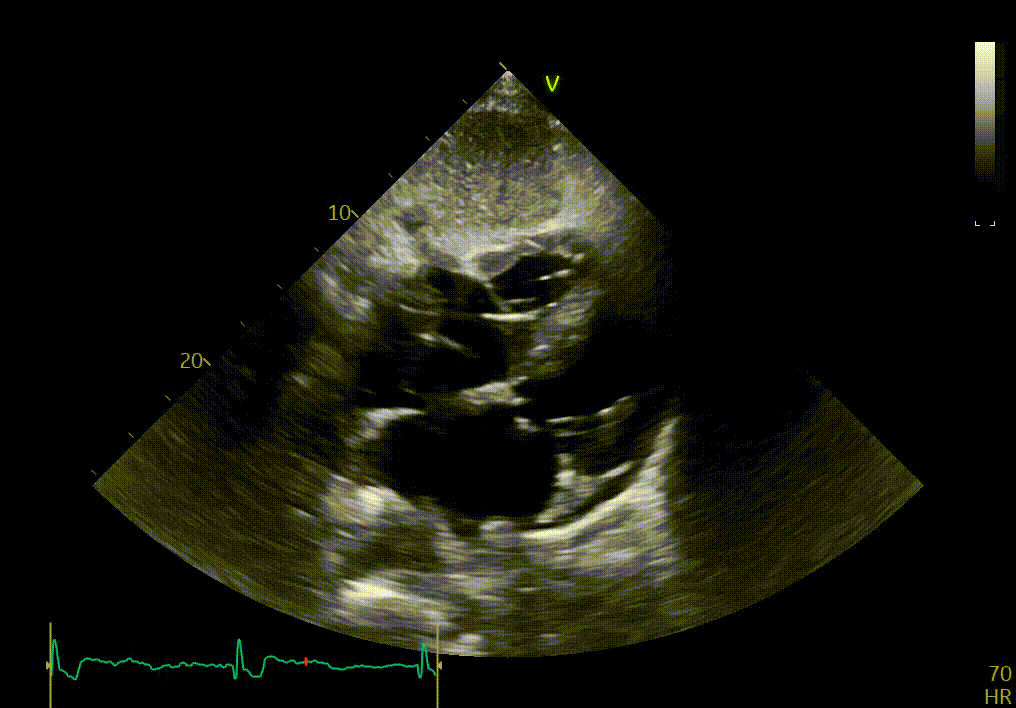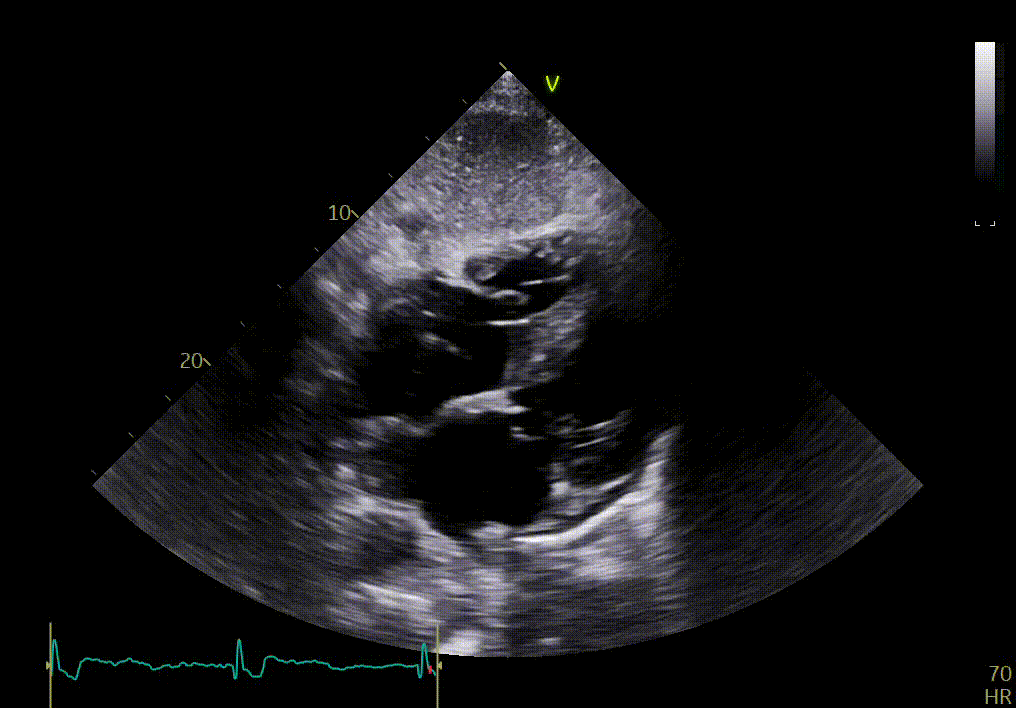


{{question6_slider}}/2 {{question6_slider === 1 ? 'Vue apicale 2 cavités' : 'Vue apicale 3 cavités' }}
Réponse
Ces images permettent en effet de confirmer certains signes déjà observés sur les vues précédentes, tels que l’épaississement des feuillets de la valve mitrale, l’hypertrophie sévère du VG, le mouvement longitudinal anormal. Elles montrent aussi une dilatation auriculaire et un myocarde anormal.


Réponse
Environ 13% des patients hospitalisés pour une IC-FEP et avec un épaississement de la paroi du VG ont un diagnostic confirmé d’ATTR-CM wt.2 Le strain longitudinal permet de détecter des signes évocateurs précoces d’amylose cardiaque.3


{{question8_slider}}/3
Réponse
Voici ce que votre confrère a indiqué dans son rapport :
- Mouvement longitudinal anormal, cinétique anormale du VG
- Faible strain longitudinal global (norme < -16%)
- Diminution en valeur absolue du strain, plus marquée au niveau du segment moyen et de la base en comparaison à l’apex


Apex
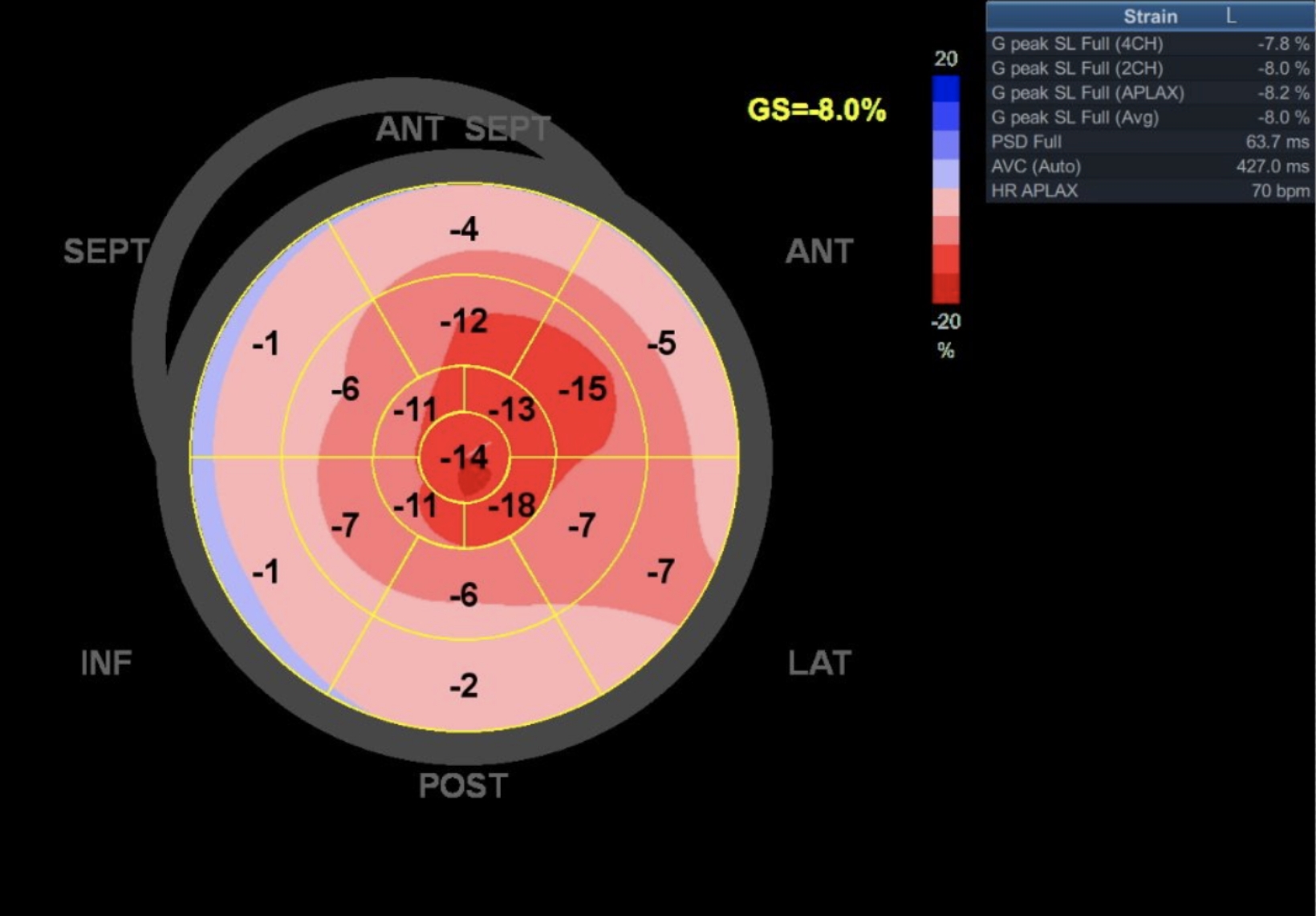
Réponse
Le plot révèle une représentation en œil de bœuf typique d'une amylose :
- Faible strain longitudinal global (norme < -16%)
- Diminution en valeur absolue du strain, plus marquée au niveau du segment moyen et de la base en comparaison à l’apex


Réponse
Cette analyse échographique a permis à votre confrère de fortement suspecter une amylose cardiaque avec de nombreux signes évocateurs, conformes aux recommandations.
En revanche, l’échocardiographie ne permet pas confirmer le diagnostic d'amylose cardiaque, ni de différencier une amylose AL d’une ATTR-CM. Il est nécessaire de réaliser une scintigraphie osseuse accompagnée d’un bilan immunologique complet afin de confirmer le diagnostic. 1,4
Les amyloses (AL ou ATTR-CM) sont des maladies mortelles, dont le diagnostic précoce est primordial. 5


- Damy T, et al. Filière CARDIOGEN - Centre de référence Amyloses Cardiaques. Protocole National de Diagnostic et de Soins (PNDS). Amyloses Cardiaques. 2020 – 2021.
- González-López E, et al. Wild-type transthyretin amyloidosis as a cause of heart failure with preserved ejection fraction. Eur Heart J. 2015;36(38):2585-2594
- Bodez D. Suspecter une amylose cardiaque : première étape vers le diagnostic. Disponible sur le site Cardio-online. Consulté le 22/11/2023
- Garcia-Pavia P, et al. Diagnosis and treatment of cardiac amyloidosis: a position statement of the ESC Working Group on Myocardial and Pericardial Diseases. Eur Heart J. 2021;42(16):1554-1568.
- Donnelly JP, Hanna M. Cardiac amyloidosis: an update on diagnosis and treatment. Cleve Clin J Med. 2017;84(12 suppl 3):12-26.